Acid D-glutamic CAS:6893-26-1 99% pulbere albă
| Număr de catalog | XD90313 |
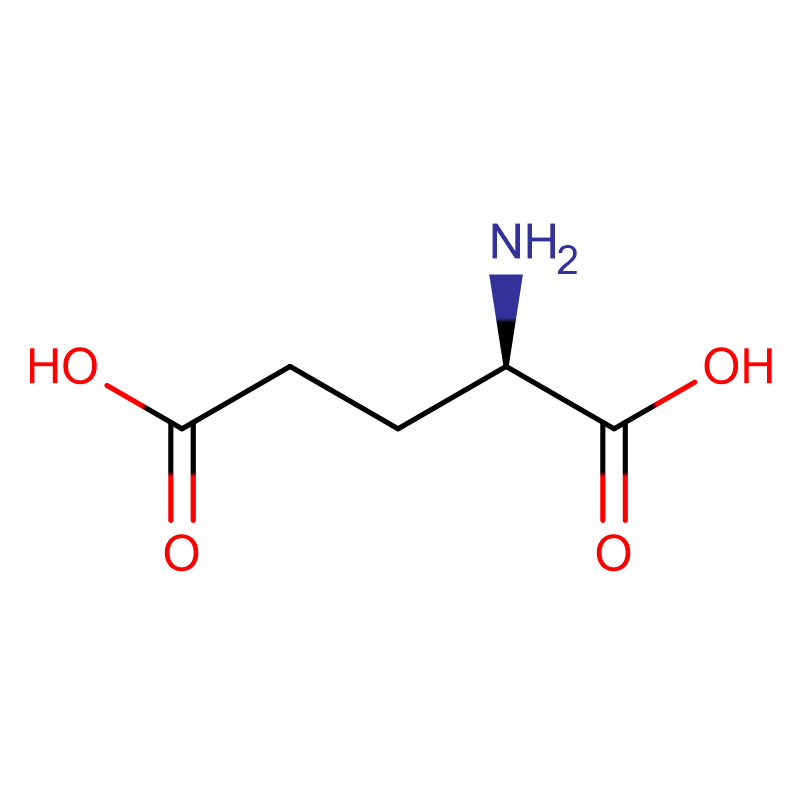
| numele produsului | Acid D-glutamic |
| CAS | 6893-26-1 |
| Formulă moleculară | C5H9NO4 |
| Greutate moleculară | 147,13 |
| Detalii de depozitare | Înconjurător |
| Cod tarifar armonizat | 29224200 |
Specificatiile produsului
| Aspect | Pulbere cristalină albă |
| Test | 99% |
| Rotatie specifica | -31 până la -32,2 |
| Metale grele | <10 ppm |
| AS | <1 ppm |
| pH | 3 - 3.5 |
| SO4 | <0,020% |
| Fe | <10 ppm |
| Pierdere prin uscare | <0,20% |
| Rezidu la aprindere | <0,10% |
| NH4 | <0,02% |
| Cl | <0,02% |
| Stare de rezolvare | >98% |
γ-glutamiltranspeptidazele (γ-GT) scindează legătura y-glutamil amidă a glutationului și transferă gruparea y-glutamil eliberată în apă (hidroliză) sau aminoacizi acceptori (transpeptidare).Aceste enzime omniprezente joacă un rol cheie în biosinteza și degradarea glutationului și în detoxifierea xenobiotică.Aici raportăm structura cristalină cu rezoluție de 3Å a Bacillus licheniformis γ-GT (BlGT) și cea a complexului său cu l-Glu.Structurile cu raze X confirmă faptul că BlGT aparține superfamiliei hidrolazei nucleofile N-terminale și dezvăluie că proteina posedă o despicatură a locului activ deschis similar cu cel raportat pentru enzima omoloagă din Bacillus subtilis, dar diferită de cele observate pentru γ-GT uman și pentru γ-GT de la alte microorganisme.Datele sugerează că legarea l-Glu induce o reordonare a cozii C-terminale a subunității mari BlGT și permit identificarea unui grup de reziduuri acide care sunt potențial implicate în recunoașterea unui ion metalic.Rolul acestor reziduuri asupra stabilității conformaționale a BlGT a fost studiat prin caracterizarea autoprocesării, activității enzimatice, denaturarii chimice și termice a patru noi mutanți unici Ala.Rezultatele arată că înlocuirea Asp568 cu un Ala afectează atât autoprocesarea, cât și stabilitatea structurală a proteinei.