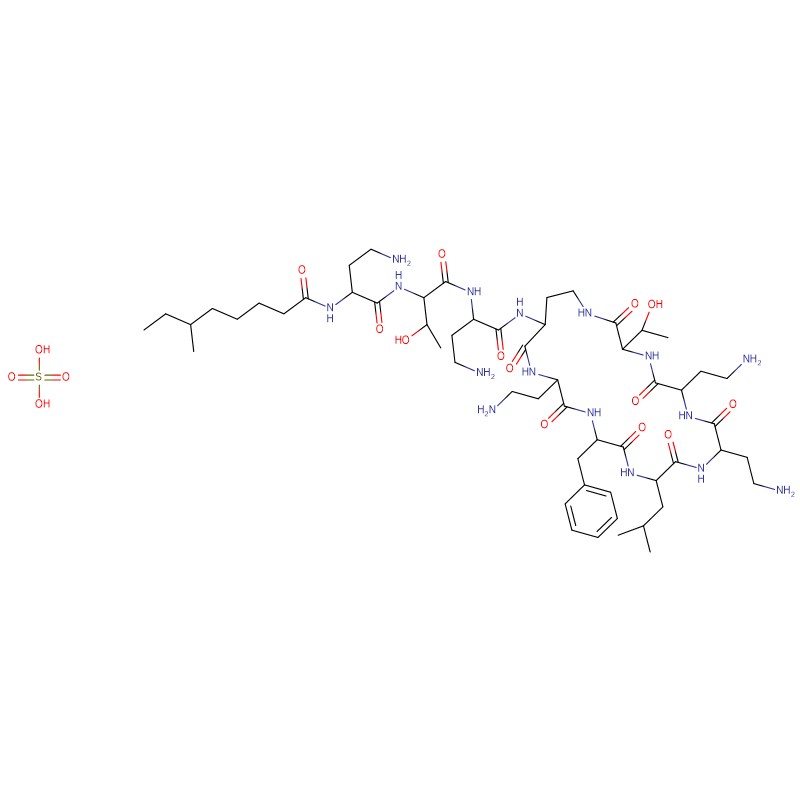
Sulfat de polimixină B CAS:1405-20-5 Pulbere albă
| Număr de catalog | XD90360 |
| numele produsului | sulfat de polimixină B |
| CAS | 1405-20-5 |
| Formulă moleculară | C55H96N16O13 · 2H2SO4 |
| Greutate moleculară | 1385,61 |
| Detalii de depozitare | 2 până la 8 °C |
| Cod tarifar armonizat | 29419000 |
Specificatiile produsului
| Concluzie | Conform cu USP35 |
| Metale grele | <20 ppm |
| pH | 5-7 |
| Identificare | Cromatografia lichidă: conformă |
| Test | 99% |
| Aspect | pudră albă |
| Pierdere prin uscare | <6% |
| Solubilitate | Liber solubil în apă, ușor solubil în etanol |
| Sulfat | 15,5% - 17,5% |
| Dimensiunea particulelor | <30µm |
| Rotație optică specifică | -78° -90° |
| Fenilalanină | 9,0%-12,0% |
| Pirogeni | Îndeplinește cerințele |
| Cenușă sulfatată | <0,75% |
| Număr total de aerobic viabil | <100cfu/g |
| Potenta | >6500 UI/mg |
Organela de secreție a proteinei ExPortal din Streptococcus pyogenes este un microdomeniu de membrană care conține fosfolipide anionice, îmbogățit în transloconi Sec și factori de biogeneză proteică postsecreție.Polimixina B se leagă de și perturbă integritatea ExPortal, ducând la secreția defectuoasă a mai multor toxine.Pentru a obține o perspectivă asupra factorilor care influențează organizarea ExPortal, a fost efectuat un screening genetic pentru a selecta mutanții spontani rezistenți la polimixină B care prezintă o integritate ExPortal îmbunătățită.Resecvențierea întregului genom a 25 de mutanți rezistenți a evidențiat de la una până la patru mutații per genom mutant grupate în principal într-un set de bază de 10 grupuri de gene.Construcția mutanților cu deleții sau inserții individuale a demonstrat că 7 gene de bază conferă rezistență și integritate ExPortal îmbunătățită prin pierderea funcției, în timp ce 3 s-au datorat probabil câștigării funcției și/sau efectelor combinatorii.Genele de rezistență de bază includ un regulator transcripțional al biosintezei lipidelor, mai multe gene implicate în achiziția de nutrienți și o varietate de gene implicate în răspunsurile la stres.Doi membri ai ultimei clase funcționează, de asemenea, ca noi regulatori ai cistein-proteazei SpeB secretate.Analiza celei mai frecvente mutații izolate, o singură deleție de nucleotidă într-o urmă de 9 reziduuri consecutive de adenină în pstS, care codifică o componentă a unui transportor Pi de mare afinitate, sugerează că această secvență funcționează ca un comutator molecular pentru a facilita adaptarea la stres.Împreună, aceste date sugerează existența unui răspuns la stres membranar care promovează integritatea ExPortal sporită și rezistența la peptidele antimicrobiene cationice.